- БЕЛКИ
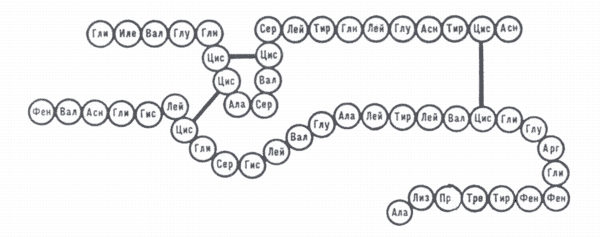
Схема аминокислотной последовательности в молекуле мономера инсулина быка.
Схема аминокислотной последовательности в молекуле мономера инсулина быка.
Вверху — цепь А, внизу — цепь B.
Жирными линиями обозначены дисульфидные связи; в кружках — сокращённые названия аминокислот.белки́, протеины (от греч. prōtos — первый, главный), высокомолекулярные азотсодержащие соединения, состоящие главным образом из остатков α-аминокислот, связанных между собой пептидными связями; важнейшая составная часть всех организмов (не менее 50% сухого вещества клетки). Б. играют главную роль во всех проявлениях жизни: обмене веществ, росте, размножении, мышечном сокращении, защитных реакциях организма и т. д. Б. — необходимая часть корма. Б. характеризуются большой молекулярной массой — от 5—10 тыс. до нескольких миллионов, и различной формой макромолекул. Растворы Б. обладают свойствами лиофильных коллоидных систем. Б. содержат около 50% углерода, 7% водорода, 23% кислорода, 16% азота и от 0 до 3% серы. При полном гидролизе молекула Б. распадается с присоединением воды на отдельные α-аминокислоты L-ряда. Все Б. построены из 20 различных аминокислот. Аминокислотный состав разных Б. неодинаков и служит важнейшей характеристикой каждого Б., а также критерием его ценности в питании (см. Аминокислотное питание). Установлена первичная структура Б., характеризующаяся своеобразной для каждого Б. последовательностью аминокислотных остатков в пептидной цепи (рис.), а также вторичная, третичная (конформация) и четвертичная структуры Б., тесно связанные с их биологическими функциями и нарушаемые денатурацией. Полностью установлена структура Б.: инсулина, рибонуклеазы, глюкагона, гемоглобина, лизоцима, цитохрома, трипсина, химотрипсина и др. Возможны случаи нарушения установленной последовательности аминокислот в цепи Б., что служит причиной так называемый молекулярных болезней.
Все Б. принято делить на простые, или протеины (собственно Б.), состоящие только из аминокислот, и сложные, или протеиды, — комплексы Б. с небелковыми соединениями (простетическими группами). К простым Б. относятся: альбумины, глобулины, гистоны, протамины, склеропротеины (коллагены, эластины, кератины) и др. Сложные Б. делят на нуклеопротеиды, хромопротеиды, гликопротеиды, липопротеиды, фосфопротеиды, металлопротеиды. Б. классифицируют также по физико-химическим свойствам на фибриллярные и глобулярные, гидрофильные (растворимые в воде) и гидрофобные (нерастворимые в воде); по источнику получения — на животные, растительные и бактериальные, на Б. мышечные, печени, лёгких, почек, нервной ткани, крови, лимфы, спинномозговой жидкости, синовиальной жидкости; по биологической активности — на Б.-ферменты, Б.-гормоны, структурные Б., антитела и т. д. Б. синтезируются в тканях из свободных аминокислот при участии нуклеиновых кислот с потреблением энергии, аккумулированной в виде АТФ. При биосинтезе обеспечивается образование Б. строго специфической структуры, которая закодирована в структурных генах (цистронах) ДНК.
В лечебной практике используют Б.-ферменты, Б.-гормоны, Б. крови. В качестве средств борьбы с инфекционными болезнями используют диагностические препараты и лечебные сыворотки, действующим началом которых являются Б.
Литература:
Белки, под редакцией Г. Нейрата и К. Бейли, пер. с англ., т. 1—3, М., 1956—59;
Гауровиц Ф., Химия и функции белков, пер. с англ., [2 изд.,], М., 1965;
Химия биологически активных природных соединений, [ч. 1—2], М., 1970—76.
Ветеринарный энциклопедический словарь. — М.: "Советская Энциклопедия". Главный редактор В.П. Шишков. 1981.
